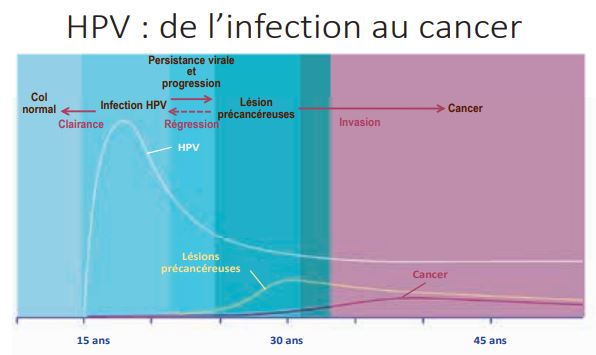
A quel moment la charge virale HPV circule le plus ?
Quand observe-t-on des lésions précancéreuses ou cancéreuses ?
Les premières infections HPV sont observées dès les premiers contacts sexuels et les infections à HPV à haut risque concernent environ 80% des femmes lors de leur existence. L’âge moyen du premier rapport sexuel en France est de 17 ans en moyenne et ne change pas beaucoup.
La caractéristique en Occident est d’avoir chez les jeunes gens une relation monogamique et sériée (avec changement régulier de partenaire). Il y a donc une très grande circulation de virus en France, et en Occident de façon générale, dans cette tranche de population. Ce sont des infections récentes par définition et en conséquence susceptibles d’être clairées y compris si des lésions existent.
A 30 ans, âge moyen de la première grossesse en France les gens se fixent et fondent une famille. Il y a donc moins de circulation de virus : le taux d’infections chute de façon drastique, mais on observe l’apparition des lésions dues probablement aux infections contractées dès le plus jeune âge. Les premières lésions précancéreuses arrivent vers 30 ans et les cancers apparaissent 10 à 15 ans plus tard en moyenne dans la majorité des cas.
Un rebond du taux d’infections à HPV vers 50 ans est observé dans les pays développés dû à un changement des habitudes sexuelles (changement de partenaire en particulier avec nouvelles infections) mais aussi, probablement, pour une grande part liée à une modification de l’immunité locale, ce qui engendre la résurgence des virus contractés au tout début de la vie sexuelle.
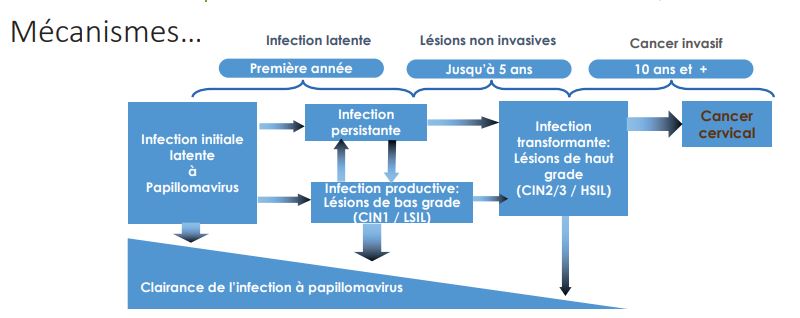
Quels sont les différents types d’infections ?
Conduisent-ils tous vers un cancer du col invasif ?
Il est possible de décrire différents types d’infections. La grande majorité des infections sont dites transitoires, c’est-à-dire qu’il va y avoir une clairance virale. Le problème est que la clairance n’est pas absolue, le virus est surement tapi dans des tissus voisins et non détectable avec nos moyens actuels (ce qui souligne l’intérêt de la vaccination précoce avant les premiers rapports).
Il existe ensuite des infections dites productives, c’est-à-dire que le virus utilise la machinerie cellulaire humaine pour survivre et se reproduire. Ces infections peuvent donner des lésions. Enfin, existent les infections dites transformantes, rares mais qui aboutiront à un cancer invasif si les lésions engendrées par ces infections transformantes ne sont pas traitées chirurgicalement encore aujourd’hui.
Tout l’enjeu actuellement est de différencier les infections productives donnant des lésions mais qui seront clairées par l’organisme et qui n’évolueront pas vers un cancer, des infections transformantes. Alors que l’observation microscopique des lésions dans ces deux types d’infection est identique, leurs biologies moléculaires sont radicalement différentes. Elles permettront de différencier les infections productives des infections transformantes, grâce à l’étude de nouveaux marqueurs qui pourront précisément définir le type d’infection et prédire ce que vont devenir les lésions observées. In fi ne, cela permettrait de réduire la quantité de conisations effectuées sur les patientes, dont le nombre est aujourd’hui bien trop élevé. Cette intervention bénigne chirurgicalement compromet la fonction de « verrou » du col utérin lors de la grossesse ce qui provoque parfois des accidents obstétricaux. Bien qu’intéressant, le génotypage (caractérisation précise du type viral) n’est pas fondamental : il n’indiquera pas l’évolution possible des lésions même si l’on sait que certains virus sont plus délétères que d’autres (par ex. HPV 16, 18, 45).
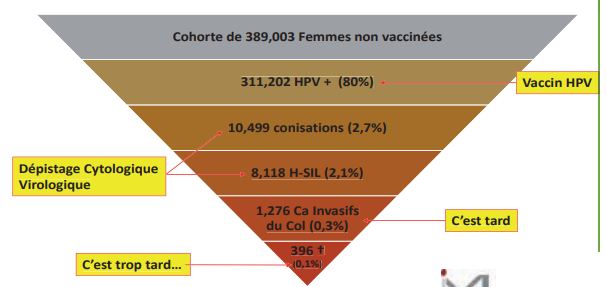
Où en est-on actuellement en France ?
L’HPV est un virus ancien, retrouvé dans différentes espèces animales et chez l’homme (on a trouvé de l’HPV chez Néenderthal). Les virus à tropisme muqueux sont peu susceptibles de mutation même si des variants sont décrits (européens, asiatiques, africains, ces derniers paraissant plus agressifs). L’INCa a publié une modélisation intéressante. Aujourd’hui sur 800 000 naissances en France, 400 000 seront des filles. 80 % d’entre elles rencontreront un HPV haut risque au cours de leur vie. Dix mille d’entre elles subiront une conisation, dont 8 000 pour des lésions à haut grade. In fine, 1 300 cancers seront déclarés, et 400 décès seront à déplorer.
Quelles grandes études avons nous manquées depuis le confinement ?
Il y a deux points importants à retenir dans la littérature récente : tout d’abord le poids des lésions extra-cervicales jusqu’à présent peu publié, et d’autre part l’utilité des nouveaux tests de triage.
L’enjeu futur de la pathologie HPV n’est plus le cancer du col de l’utérus mais les autres lésions (ORL, anales, …) qui sont de plus en plus fréquentes et qui ne sont pas dépistées. La seule prévention de ces lésions extra-cervicales est primaire en vaccinant contre les virus à haut risque les plus fréquemment en cause dans ces lésions.
Les lésions ORL HPV induites touchent notamment les amygdales et tout particulièrement les cryptes amygdaliennes : leur reconnaissance est délicate. Par ailleurs, on ne connait pas les lésions précancéreuses à ce niveau-là même si l’on sait que d’autres facteurs que l’HPV ont un rôle majeur dans la cancérisation comme l’alcool et le tabac. Les oncologues ORL ne disposent pas encore des outils de dépistage et diagnostiques comme les gynécologues qui ont frottis à visée cytologique et virologique et colposcopie. A contrario, les gastroentérologues ont la possibilité d’effectuer des frottis à visée virologique et cytologique) et des anuscopies haute résolution pendant digestif de la colposcopie pour orienter leurs biopsies anales. Dans une étude hollandaise rigoureuse faite en population publiée en 20171, 180 000 patientes traitées pour lésions cervicales de haut grade (CIN3) et 180 000 patientes non traitées ont été suivies pendant 14 ans en moyenne. On constate que les femmes traitées pour des lésions cervicales de haut grade étaient plus à risque de faire une récidive au niveau du col, précancéreuse et cancéreuse, mais aussi au niveau de l’anus, vagin, vulve et ORL. Deux conclusions doivent en être tirées. Il faut donc premièrement surveiller le col après conisation mais aussi les autres localisations. Nous ne sommes certainement pas égaux devant l’HPV : certains sujets ont une propensation particulière à développer des lésions de haut grade tant au niveau du col qu’au niveau des autres localisations sans que l’on soit encore capable de les identifier. Une étude américaine2, ayant suivi une cohorte de patientes traitées de lésions cervicales, a montré que celles qui avaient de l’HPV 16 (génotype le plus fréquent et le plus agressif) et qui avaient plus de 45 ans avaient un risque majoré de développer des lésions précancéreuses et cancéreuses de l’anus. Il est donc important de sensibiliser les patientes à ce sujet.
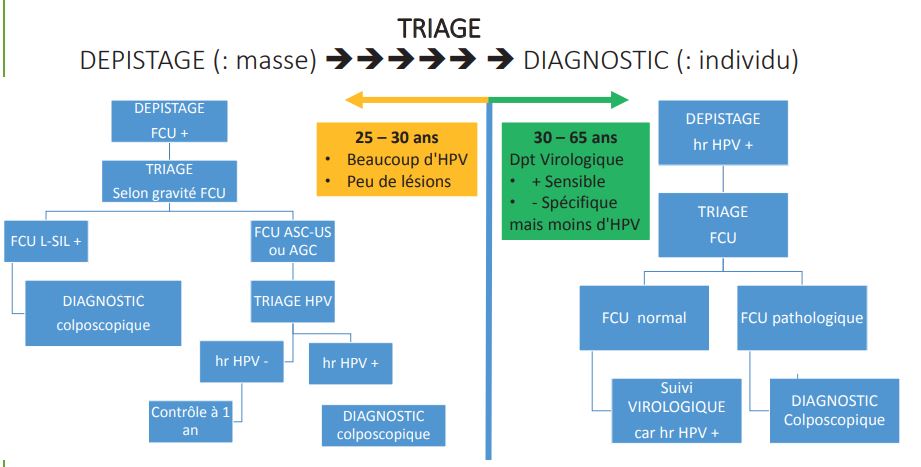
Les nouveaux tests de triage pourraient grandement aider à la compréhension et la détermination de l’évolution des lésions.
Le triage est fondamental permettant de passer du dépistage (s’adressant à une population) à l’individu à qui l’on doit une réponse personnalisée après qu’il ait effectué son test de dépistage. Une des premières méthodes utilisée a été le double immunomarquage cytologique à la recherche de la surexpression de la protéine P16 (en cas d’inflexion vers la cancérisation) et du facteur de prolifération Ki67 au niveau de la cellule cervicale infectée.
Il serait très intéressant de prendre en considération la surexpression des « early genes » de l’HPV comme E4 détectable en immunohistochimie. Le gène E4 est surexprimé par l’HPV en phase productive : il serait le témoin d’une infection productive ayant donc un bon pronostic avec une forte probabilité de clairance virale et de régression des lésions éventuellement associées. A contrario, la méthylation de deux promoteurs de gènes suppresseurs de tumeur (tels FAM-19-A4 et miR-124-2) au niveau des cellules cervicale infectées témoignerait d’une infection transformante, et donc d’un mauvais pronostic en raison d’un risque d’évolution vers l’invasion. Cette étude de biologie moléculaire est en cours d’évaluation. Ces méthodes de triage sont particulièrement intéressantes. Leur but est d’isoler les patientes ayant des lésions en relation avec une infection transformante, donc à risque de cancer invasif de manière fiable et reproductible car non dépendante de l’œil humain et de leur proposer un traitement adéquat, mais surtout à l’inverse d’épargner des patientes porteuses de lésions en relation avec des infections productives qui n’évolueront pas vers l’invasion. Une étude hollandaise montre que pour des patientes de plus de 30 ans porteuses d’un virus HPV à haut risque, 20% d’entre elles présentent des lésions de bas grade (ASCUS/LSIL) pour lesquelles une colposcopie est requise. Une fois sur 2, les patientes n’ont pas de lésions ou des lésions de bas grade qui ne sont pas considéréesaujourd’hui comme des lésions pré-cancéreuses. Un tirage moléculaire permettrait d’orienter vers la colposcopie les seules patientes réellement à risque de développer des cancers invasifs.
Où en est la vaccination HPV dans le monde et en France ?
La vaccination HPV en France a bénéficié de 2 choses : d’une part le courage politique de l’ancienne ministre de la Santé qui a promu les vaccinations obligatoires, ce qui a créé un électrochoc pour encourager les français/françaises et leurs enfants à se faire vacciner (même si la mesure ne concernait pas l’HPV directement). Et d’autre part, la pandémie COVID qui a encouragé la démarche de vaccination en montrant son intérêt à très large spectre. Comme l’explique le Dr Olivier Jourdain dans son livre3, il restera toujours une frange de la population réfractaire à la vaccination. Aujourd’hui, plus de 30% des jeunes filles sont vaccinées en France, ce qui est en augmentation. Cela reste loin des chiffres recommandés par l’OMS et du Haut Comité de Vaccination qui souhaitent plus de 80% en 2030. En Europe, les britanniques sont bien classés avec 80% de jeunes filles vaccinées dès le plus jeune âge à l’école.
La vaccination s’est révélée efficace en population. Comme le dit David Elia, le modèle est l’Australie qui a vacciné tôt et massivement, et a rendu cette vaccination quasi obligatoire et en école. Si la vaccination est faite tôt, les jeunes gens sont d’une part en grande majorité naïfs vis-à-vis du virus (la vaccination n’étant pas thérapeutique) et d’autre part développent une plus forte et durable réaction immunitaire lors de la vaccination. Ainsi en Australie comme dans d’autres pays ayant pratiqué une politique vaccinale volontariste on a constaté en population une diminution des lésions bénignes (verrues génitales liées à 90% à HPV 6 et 11), mais aussi pré-malignes. De plus, la vaccination a été faite très tôt chez les garçons aussi, ce qui a eu un double impact : par définition, il y a eu moins de virus en circulation (et donc une protection des non vacciné(e)s par les vacciné(e)s, ce que l’on qualifie « d’immunité de troupeau », mais aussi une prise de conscience de l’impact des pathologies HP induites tant chez les filles que chez les garçons.
Par exemple, si en France, 50 cancers du pénis sont déclarés annuellement, ce qui est numériquement négligeable, on constate chez les hommes ayant des relations avec d’autres hommes, une augmentation des cancers de l’anus à 90% liés à HPV16 donc parfaitement accessibles à la prévention vaccinale voire au dépistage virologique ou cytologique.
La vaccination permet aussi une diminution des cancers invasifs du col utérin en population. Un cancer invasif est un cancer qui a gagné la profondeur des tissus où siègent les vaisseaux sanguins et lymphatiques avec par conséquent un risque de dissémination métastatique. Si les traitements ménageant la fertilité sont la règle sur les lésions pré-malignes non invasives, le traitement classique des cancers invasifs du col utérin n’autorise pas de grossesse ultérieure (même si se développent des prises en charge innovantes permettant dans certains cas rigoureusement sélectionnés de conserver un utérus propre au développement d’une grossesse). Récemment, une étude suédoise4 a montré une diminution conséquente du nombre de cancers invasifs du col de l’utérus chez les femmes vaccinées, (laissant supposer un effet identique sur les autres localisations ORL, anales, vulvaires, vaginales). En effet, plus d’1,1 million de patientes non vaccinées ont déclaré 538 cancers et sur les plus de 520 000 patientes vaccinées, seules 189 ont déclaré un cancer, ce qui a permis de montrer une diminution de plus de 60% de cancers invasifs. Cette étude a permis de lever les doutes émis par certains sur l’efficacité du vaccin HPV vis-à-vis des cancers invasifs.
La question de la vaccination après traitement des lésions précancéreuses se pose de manière aigue en France. Ces propos font encore débat mais les patientes qui font des lésions prémalignes sont plus à risque d’en refaire et une méta-analyse regroupant plusieurs études de femmes vaccinées après conisation pour lésions de haut grade montre qu’il y a moins de lésions et de récidives au niveau du col5. Cela n’a pas encore été démontré, et cela sera surement le cas, pour les cancers anaux, vulvaires, vaginaux et ORL. Bien sûr, la vaccination ne traitera pas les lésions liées au virus initialement en cause, mais il est rare qu’il y ait des co-infections chez les sujets qui ne sont pas immunodéprimés. Ainsi, une femme qui a des lésions cervicales HPV16 induites, qui sera vaccinée après traitement de ces lésions contre HPV 18 / 31 /33 / 45 / 52 / 58, ne fera pas de lésions sur le col, et probablement ailleurs, HPV 18 / 31 / 33 / 45 / 52 / 58 induites.
La vaccination post thérapeutique est un axe important même si la France reste prudente à ce sujet. Ceci est pourtant systématique par exemple au Canada, dont l’objectif est 0% de cancer HPV induit.
Quels sont les progrès concernant le cancer du col utérin ?
Il est tout d’abord nécessaire de faire un état des lieux rapide. La vaccination correspond à de la prévention primaire en agissant sur l’agent causal. Le dépistage correspond à de la prévention secondaire qui servira à traiter des lésions précancéreuses pour éviter qu’elles ne dégénèrent en cancer. En France, seulement plus de 30% des jeunes femmes sont vaccinées. Même si ce chiffre est en augmentation, il reste faible. Par ailleurs, 40% des femmes de 30 à 65 ans ne sont pas correctement suivies, et ceci est dû à un nombre en décroissance des gynécologues, une mauvaise couverture territoriale, et des inégalités socio-culturelles majeures. Les femmes qui font des cancers du col sont généralement des femmes mal suivies.
Pour les cancers invasifs, plusieurs points sont inquiétants. Il est vrai que l’on observe une diminution de l’incidence des nouveaux cas des cancers du col et de la mortalité liée, mais la pente de décroissance chute entre 1990 et 2018 selon l’étude de l’INCa. Par ailleurs, la mortalité à 5 ans du cancer invasif du col a chuté : 68 % de survie à 5 ans, 62% actuellement. Les résultats thérapeutiques sont moins bons alors que les moyens progressent.
Cela est dû au fait que les cancers du col de l’utérus à bon pronostic sont moins fréquents grâce au dépistage sans que les cancers les plus agressifs fréquents chez les patientes jeunes d’évolution très rapide échappant au dépistage cytologique et de traitement plus difficile n’aient vu leur fréquence diminuer.
Les nouvelles modalités de dépistage ont été grandement simplifiées. La complexité des recommandations de dépistage laissait perplexe les médecins non spécialisés en gynécologie.
Aujourd’hui, n’importe quel praticien, généraliste ou sagefemme peut faire et interpréter les résultats issus du dépistage simplement. Il y a 2 conduites à tenir sans que le prélèvement (le frottis) ait été modifié : on utilise en effet le même matériel (validé au niveau national) pour un geste identique. Entre 25 et 30 ans (où il y a beaucoup de virus en circulation mais encore peu de lésions prémalignes), alors qu’entre 30 et 65 ans, il faut réaliser des frottis à visée virologique en raison de la moindre prévalence du portage d’HPV à haut risque et la plus grande fréquence des lésions pré-malignes. Il est intéressant de privilégier les frottis virologiques pour 2 raisons : ce test est plus sensible6 pour dépister les lésions de haut grade et la durée de protection du test virologique négatif est d’une durée de 5 ans7, donc supérieure de 2 ans à la durée de protection conférée par une cytologie négative.
Actuellement, on tend vers à une personnalisation des traitements des cancers invasifs du col utérin. Deux exemples : la possibilité de préserver la fertilité soit d’une jeune femme présentant un cancer du col utérin invasif sous réserve que le cancer soit de petite taille, sans que les vaisseaux de la tumeur contiennent des emboles cellulaires tumoraux, et sans atteinte métastatique ganglionnaire, soit chez une jeune femme ayant un cancer plus développé avec chimiothérapie première et l’étude internationale SHAPE8, à laquelle la France participe, qui propose dans les petits cancers du col à un stade débutant une hystérectomie moins élargie avec donc moins de conséquences délétères fonctionnelles pour la patiente.
Enfin, une polémique se développe sur les voies d’abord chirurgicales dans les cancers invasifs du col utérin. La chirurgie mini-invasive (coelioscopique et robotique) plus simple, moins agressive, plus respectueuse de l’anatomie (meilleure dissection, respect des nerfs, …) a peu à peu remplacé la chirurgie à ventre ouvert. Une étude américaine randomisée (chirurgie mini-invasive versus chirurgie à ventre ouvert) a comparé les types de chirurgie avec des méthodologies exigeantes9 : les interventions ont été filmées et revues par des experts pour preuve de qualité de l’acte chirurgical. Pour des cancers de bons pronostics, il a été observé un différentiel de 10% de survie à 5 ans en défaveur de la chirurgie mini-invasive. Une autre étude américaine10, cette fois ci rétrospective, a abouti aux mêmes chiffres. L’étude rétrospective européenne SUCCOR Study11 montre que les chiffres des européens sont comparables avec le même différentiel de 10% en faveur de la chirurgie ouverte. Mais l’intérêt de cette étude est qu’elle pointe du doigt les manipulations du col utérin en peropératoire lors de la chirurgie mini-invasive qui seraient responsables d’une dissémination des cellules cancéreuses : en conséquence, les chirurgiens français du groupe GINECO ont établi des propositions qui visent à une information loyale en pré-opératoire des patientes, à l’adoption de mesures techniques limitant les manipulations du col utérin lors de la chirurgie mini-invasive (pas de manipulateurs utérins, curiethérapie pré-opératoire pour les tumeurs de taille intermédiaire, possibilité d’exclusion du col utérin par voie vaginale, conisation en début d’intervention pour les plus petites tumeurs…) et à réserver la chirurgie mini-invasive à des équipes entraînées.
Quelles sont vos espoirs et craintes au sein de votre service ?
De nombreux espoirs ont été émis par le service, qui recoupent ceux de toutes les spécialités médicales hospitalières.
Il est tout d’abord nécessaire de mieux redéfinir pour chacun les objectifs à atteindre. Il serait plus pragmatique de confier les consultations spécialisées aux gynécologues (contraception complexe, infertilité…) et les chirurgies de recours (comme par exemple, endométriose et chirurgie carcinologique) aux équipes multidisciplinaires disposant de moyens ad hoc, et de promouvoir les consultations de suivi par les médecins généralistes et les sages-femmes. Il n’est peut-être pas indispensable d’augmenter drastiquement le nombre de médecins gynécologues (qu’il faut par ailleurs former) mais de recadrer leur fonction et de réfléchir au sein des Groupements Hospitaliers de Territoire (qui sont une réelle opportunité dont les médecins doivent s’emparer) à une répartition plus homogène des compétences et d’encourager la délégation de tâches au sein de réseaux de soins. Il serait intéressant aussi de mettre plus de moyens dans les professions paramédicales (infirmière, aide-soignante) qui sont en souffrance professionnelle et dont le travail n’est pas valorisé (salaire faible, gardes nocturnes et week-end, horaires décalés, pas de crèche, pas de sérénité). Le turnover important dans ces professions reflète les problèmes actuels.
Il y a aussi des craintes qui apparaissent, et particulièrement en qui concerne la surcharge de travail des plus jeunes. Tous les services de gynécologie obstétrique en pâtissent et singulièrement les plus petites structures où la permanence des soins ne repose que sur un nombre restreint de praticiens. Le volume de connaissances à acquérir pour les internes des hôpitaux ne cesse de croître avec les progrès médicaux, tant sur le plan théorique que pratique. Des mesures alternatives se mettent en place dans les hôpitaux et cliniques qui accueillent et forment les jeunes médecins : développement de la simulation, création du corps des « Docteurs Juniors » en fin d’internat, enseignement national reposant sur des référentiels édités par les meilleurs spécialistes, encadrement des seniors contractualisé, orientation précoce après d’un socle de base de connaissances indispensables vers une sous-spécialité (obstétrique, reproduction chirurgie…). Reste que la spécialité est exigeante moralement et physiquement et que la féminisation de notre profession est mal appréhendée : aujourd’hui à Rennes nous avons 42 internes de Gynécologie Obstétrique et Gynécologie Médicale en formation, avec 41 jeunes femmes et 1 jeune homme et très clairement motivation et compétence ne sont pas liées au genre ; un service ou un hôpital qu’il soit public ou privé qui oublie cette réalité en ne permettant pas aux jeunes médecins en formation et aux praticien(nes) qualifiés de bénéficier d’un équilibre juste entre vie professionnelle et personnelle court à sa perte à très court terme.
Très clairement, plus que l’argent, c’est l’épanouissement qui est visé par les médecins. Cette dimension ne peut être ignorée ou pire négligée
PR JEAN LEVÊQUE
Propos recueillis par Cindy Patinote.
RÉFÉRENCES
1. Ebisch RMF, et al. Long-Lasting Increased Risk of Human Papillomavirus-Related Carcinomas and Premalignancies After Cervical Intraepithelial Neoplasia Grade 3: A Population-Based Cohort Study. J Clin Oncol. 2017. 35(22):2542-2550. doi: 10.1200/JCO.2016.71.4543.
2. Lin C, et al. Cervical determinants of anal HPV infection and high-grade anal lesions in women: a collaborative pooled analysis. Lancet Infect Dis. 2019. 19(8):880-891. doi: 10.1016/S1473-3099(19)30164-1.
3. Enquête au pays des Anti-Vax, Olivier Jourdain, Editeur : PLON, Date parution : 05/2021, ISBN 10 : 2259306748, ISBN 13 : 9782259306744.
4. Lei, J et al. HPV Vaccination and the Risk of Invasive Cervical Cancer. N Engl J Med. 2020. 383:1340-1348 doi: 10.1056/NEJMoa1917338.
5. Jentschke M, et al. Prophylactic HPV vaccination after conization: A systematic review and meta-analysis. Vaccine. 2020. 38(41):6402-6409. doi: 10.1016/j. vaccine.2020.07.055.
6. Arbyn M, et al. Evidence regarding human papillomavirus testing in secondary prevention of cervical cancer. Vaccine. 2012. 30 Suppl 5:F88-99. doi: 10.1016/j. vaccine.2012.06.095. Erratum in: Vaccine. 2013 Dec 16;31(52):6266.
7. Ronco G, et al. International HPV screening working group. Efficacy of HPV-based screening for prevention of invasive cervical cancer: follow-up of four European randomised controlled trials. Lancet. 2014. 383(9916):524-32. doi: 10.1016/S0140-6736(13)62218-7. Erratum in: Lancet. 2015 Oct 10;386(10002):1446.
8. Van der Velden J, Mom CH. Tailoring radicality in early cervical cancer: how far can we go? J Gynecol Oncol. 2019.30(1):e30. doi.org/10.3802/jgo.2019.30.e30
9. Ramirez PT, et al. Minimally Invasive versus Abdominal Radical Hysterectomy for Cervical Cancer. N Engl J Med. 2018. 379(20):1895-1904. doi: 10.1056/NEJMoa1806395.
10. Melamed A, et al. Survival after Minimally Invasive Radical Hysterectomy for Early-Stage Cervical Cancer. N Engl J Med. 2018. 379(20):1905-1914. doi: 10.1056/ NEJMoa1804923.
11. Chiva L, et al. SUCCOR study Group. SUCCOR study: an international European cohort observational study comparing minimally invasive surgery versus open abdominal radical hysterectomy in patients with stage IB1 cervical cancer. Int J Gynecol Cancer. 2020. 30(9):1269-1277. doi: 10.1136/ijgc-2020-001506
GENESIS – N° 206 – JUIN / JUILLET 2021







9 commentaires