 Ce Selective Progesterone Receptor Modulators (SPRM) provoque un antagonisme partiel de la progestérone au sein des myomes et de l’endomètre ainsi qu’une inhibition de la prolifération cellulaire au niveau des myomes. Il est indiqué en pré-opératoire pour traiter les symptômes modérés à sévères des fibromes utérins et ainsi faciliter le geste chirurgical ou en séquences répétées pour éviter la chirurgie.
Ce Selective Progesterone Receptor Modulators (SPRM) provoque un antagonisme partiel de la progestérone au sein des myomes et de l’endomètre ainsi qu’une inhibition de la prolifération cellulaire au niveau des myomes. Il est indiqué en pré-opératoire pour traiter les symptômes modérés à sévères des fibromes utérins et ainsi faciliter le geste chirurgical ou en séquences répétées pour éviter la chirurgie.
La prévalence des myomes utérins est importante : entre 20 et 50% des femmes ont, ou auront, ou ont eu un ou plusieurs myomes.
Les myomes induisent éventuellement plusieurs complications, parmi les principales : les ménorragies en premier lieu mais aussi selon les cas la gêne ou douleurs pelviennes en cas de myomes très volumineux, la nécrobiose aseptique, la torsion, l’infertilité. Plus de la moitié d’entre eux sont totalement asymptomatiques et c’est l’abstention thérapeutique qui prime alors. Les myomes s’atrophient, diminuent de volume, se calcifient parfois en post ménopause non traitée.
Les traitements médicaux étaient jusqu’ici purement symptomatiques : progestatifs ovario-bloquants ou non, DIU hormonal, antihémorragiques.
Quant aux traitements chirurgicaux ils consistent selon les cas en myomectomies (endocavitaires ou non), en endométrectomies, en hystérectomies souvent. Les myomes sont la première cause d’hystérectomies en France.
L’étiologie est encore aujourd’hui mal connue. Les fibromes ont plus de récepteurs à estrogènes et progestérone que le myomètre lui-même.
Les SPRM : une nouvelle thérapeutique des myomes
Les Selective Progesterone Receptor Modulators, modulateurs sélectifs des récepteurs de la progestérone sont des molécules spécifiques qui se fixent sur les récepteurs de la progestérone et qui, selon les cas, induisent ou bloquent (agonistes ou antagoniste) la transcription de gènes spécifiques. Ce sont par exemple la mifépristone bien connue et utilisée pour l’IVG médicamenteuse (RU486), l’asoprisnil, l’onapristone et l’ulipristal acétate (déjà utilisé en contraception d’urgence)
Esmya® sous la forme de comprimés de 5mg d’ulipristal acétate est indiqué pour le traitement médical des myomes utérins. Ce médicament provoque un antagonisme partiel de la progestérone au sein de l’hypophyse, des myomes et de l’endomètre : il inhibe partiellement FSH en freinant le plus souvent (environ 80%) l’ovulation (progestérone à 0,3 ng/ml), tandis que l’estradiol est maintenu à un taux moyen de première phase de cycle.
Il provoque aussi une inhibition de la prolifération cellulaire en même temps qu’il induit une apoptose cellulaire au niveau des myomes.
Xu Q montre in vitro que l’ulipristal acétate diminue la concentration des facteurs de croissance VEGF- A, VEGF-B et ADM impliqués dans l’angiogenèse des seules cellules des myomes utérins alors que la progestérone en augmente la concentration aussi bien dans les cellules myomateuses qu’endométriales 1.
Action sur l’endomètre
L’administration d’Esmya® tarit le plus souvent les éventuelles ménorragies dès la première semaine d’administration et la majorité des patientes resteront en aménorrhée jusqu’à la fin de la séquence de traitement. En cas d’arrêt du traitement après une séquence les règles seront à nouveau au rendez-vous mensuel 4 ou 5 semaines après l’arrêt.
Il faut bien connaître les aspects spécifiques de l’endomètre chez les patientes sous ulipristal acétate, aussi bien en échographie qu’en histologie. Ces changements histologiques sont désignés comme « Changements endométriaux associés au modulateur du récepteur de la progestérone » (Progesterone Receptor Modulator Associated Endometrial Changes– PAEC) et ne doivent pas être confondus avec une hyperplasie endométriale. Chez environ 60% des femmes on constate les modifications spécifiques des PAEC : en histologie l’endomètre est modérément épais (non hyperplasique) et présente des kystes glandulaires de faible index mitotique. Ces aspects sont réversibles à l’arrêt du traitement. En échographie l’endomètre peut atteindre 16 mm de berge à berge et présenter une échostructure spécifique des PAEC.
Les études ayant conduit à l’AMM : PEARL I & PEARL II
Leur méthodologie est remarquable et exemplaire : randomisée versus placebo en double aveugle (le « Gold Standard » de l’épidémiologie)
PEARL I
Protocole :
Étude randomisée, multicentrique, en double aveugle, comparant deux doses fixes d’UPA (5 mg et 10 mg) à un placebo, en association avec du Fer, en traitement préopératoire du fibrome utérin. 3
A l’inclusion les femmes – non ménopausées – d’âge moyen 41,6 ± 5,6, sont porteuses de myomes dont un au moins > 3cm (et < 10 cm) et présentant des ménorragies et une hémoglobine < 10,2 g/litre. Ce sont des femmes éligibles aux techniques de chirurgie traditionnelles.
Elles reçoivent le traitement à J+4 et pendant 13 semaines (1 comprimé d’Esmya®/jour).
Résultats :
- Toutes les femmes avaient un PBAC > 100 (Pictorial Bleeding Assessment Chart = charte graphique d’évaluation de la perte sanguine) à l’inclusion. Les patientes ayant un score PBAC < 75 : 7 jours après le début du traitement sont de l’ordre de 75/80 %. (Figure 1)
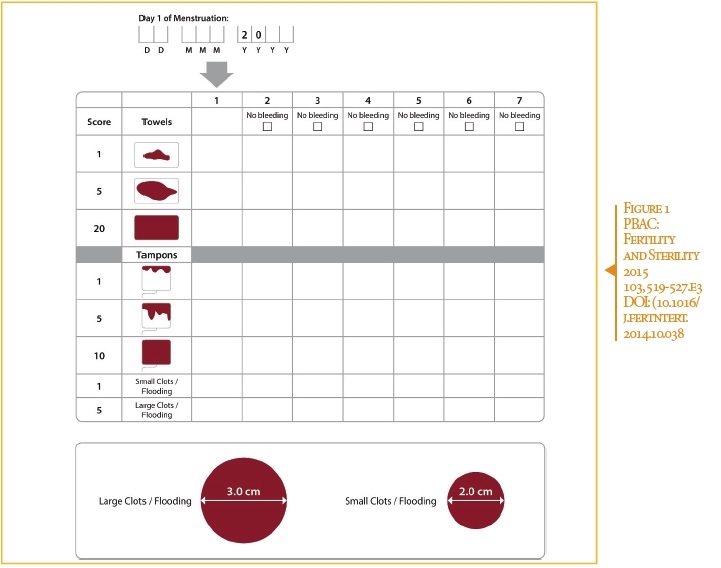
- Les patientes ayant un score PBAC normalisé sont 19% à la semaine 13 dans le groupe traité versus 91% dans le groupe placebo (*significatif).
- La diminution du volume des myomes mesurée par IRM est de -21,2% versus +3% chez les placebos (p=0,002) à la semaine 13. Elle est > 25 % chez plus de 40 % des patientes (p=0,01).
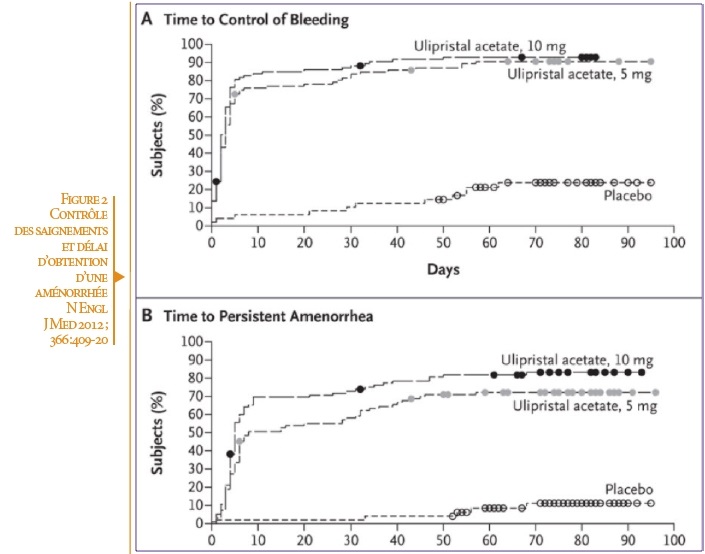
- 73,4% des femmes sont en aménorrhée (score PBAC ≤ 2 sur 28 jours) à la semaine 13 versus 6,3% chez le groupe placebo. (Figure 2)
- Aucune différence significative entre le groupe ulipristal d’acétate et le groupe de placebo pour le pourcentage de survenue des effets indésirables.
- 11,3 % des femmes traitées présentent une épaisseur endométriale > 16 mm à la 13e semaine. Après 26 à 38 semaines cet aspect est toujours normalisé.
PEARL II
Protocole :
Étude randomisée, multicentrique, en double aveugle, comparant deux doses fixes d’UPA (5 mg et 10 mg) à l’acétate de leuproréline (3,75 mg par voie intramusculaire, 1 fois par mois), en traitement préopératoire du fibrome utérin 4.
Les critères d’inclusion dont les mêmes que ceux de PEARL I.
Résultats :
L’ulipristal acétate fait aussi bien que l’acétate de leuproréline. À la semaine 13, le contrôle des saignements est de 89% pour le groupe ulipristal versus 90% pour le groupe leuproréline (PBAC <75)
Le délai en jours nécessaire pour obtenir une aménorrhée (PBAC <2) chez 50% des femmes est en moyenne de 7 jours pour ulipristal acétate versus 21 pour l’acétate de leuproréline.
La diminution du volume médian total des 3 plus gros fibromes (par échographie) à l’arrêt du traitement à la semaine 13 est de 53% pour ulipristal acétate versus 36% pour le groupe leuproréline.
Cette diminution de volume est persistante dans le temps à la semaine 38 chez 44,8% des femmes du groupe ulipristal versus 16,5% des femmes du groupe leuproréline.
- L’estradiolémie reste en moyenne autour de 60 pg/ml dans le groupe ulipristal acétate versus des taux de E2 ménopausiques pour le groupe leuproréline pendant les 13 semaines de traitement – 11% des femmes ulipristal rapportent des bouffées de chaleur modérées jusqu’à la semaine 13 versus 40 % chez les femmes leuproréline.
- Les effets indésirables graves survenus sont au nombre de 1 cas de céphalées (sur 97 femmes) et 1 cas cancer thyroïdien pour les 97 femmes ulipristal versus 1 cas d’hémorragie interne et 1 cas d’infection pulmonaire dans le groupe leuproréline (sur 101 femmes).
- L’épaisseur de l’endomètre se maintient autour de 8/10 mm (mesuré en échographie pour PEARL II) de l’inclusion jusqu’à la semaine 13 pour ulipristal. 11,8% ont une épaisseur endométriale autour de 10 mm à la semaine 13. À la semaine 38, l’épaisseur endométriale du groupe ulipristal est normalisée. L’endomètre montre un aspect PAEC chez 74,2% des femmes (PEARL I) et 65,1% des femmes (PEARL II) à la semaine 13 et respectivement 14,2% et 17,3% à la semaine 38.
- Des biopsies endométriales ont été pratiquées aussi bien pour PEARL I que PEARL II : absence d’hyperplasie endométriale et de cancers à la semaine 13 et lors du suivi du groupe ulipristal. (1 cas d’hyperplasie dans le groupe placebo et 1 cas de polype bénin dans le groupe leuproréline).
PEARL IV (PARTIE 1)
Protocole :
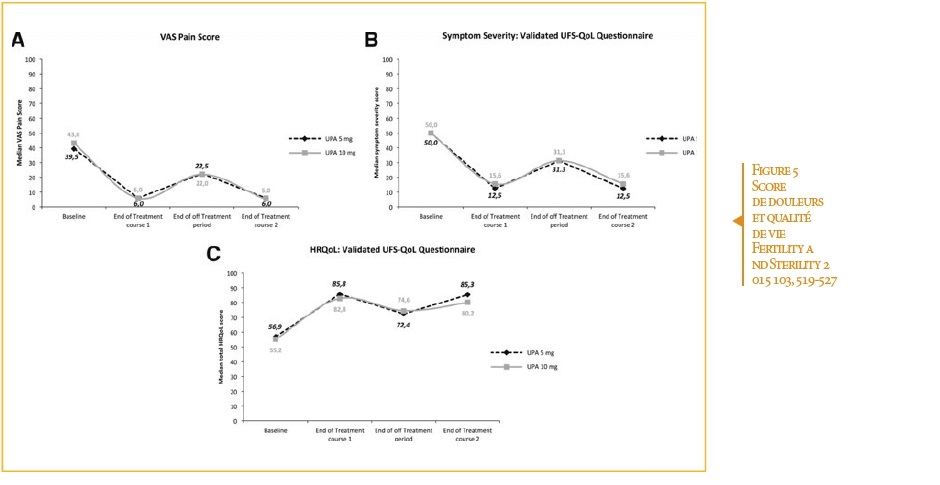
Douleurs et qualité de vie : 2 cycles de traitement (2×12 semaines). (Figure 3)
PEARL IV (PARTIE 2)
Jusque 4 cycles de traitement (2×12 semaines supplémentaires). (Figure 4)
Cette étude randomisée multicentrique de phase III et en double aveugle 5 recherche l’efficacité et la tolérance de 2 cycles de traitement de 3 mois d’UPA 5 mg. Elle inclut des femmes âgées de 18 à 50 ans non ménopausées avec ≥ 1 myome utérin mesurant ≥ 3 cm de diamètre mais aucun myome > 12 cm de diamètre avec un score PBAC > 100 pendant les jours 1 à 8 des règles, des cycles réguliers de 22 à 35 jours (FSH <20 mIU/mL) et un volume de l’utérus dont la limite supérieure est équivalente à 16 semaines de grossesse.
Résultats :
- Le contrôle des saignements (défi ni comme « pas de saignements sévères » et un maximum de 8 jours de saignements durant les 56 derniers jours de traitement) concerne 88,3% des patientes après le premier cycle de traitement et 87,9 % après le deuxième cycle. Le score PBAC médian passe de 224 à 123 après la séquence 1 et 92 après la séquence 2.
- Les patientes en aménorrhée sont 71,8% et 74,1% respectivement après la séquence 1 et 2. Le délai médian d’apparition de l’aménorrhée après chaque cycle d’UPA 5 mg est de 5 jours.
- La variation du volume médian des 3 plus gros fibromes versus l’inclusion est respectivement de -38% et -53,8% après les séquences 1 et 2 (évaluée par échographie). Le pourcentage de patientes présentant une diminution de ≥ 25% du volume médian des fi bromes est respectivement de 62,3% et 73,9% après 1 et 2 cycles d’ulipristal acétate 5mg. Le pourcentage de patientes présentant une diminution ≥ 50% du volume médian des fibromes est respectivement de 37,2% et 53,7% après 1 et 2 cycles d’ulipristal acétate 5mg.
Effets indésirables :
- Céphalées et bouffées de chaleur sont les effets indésirables les plus fréquents. Ils n’excèdent pas 10 % des femmes. 5 % des patientes interrompent leur traitement en raison d’effets indésirables.
Effets sur l’endomètre :
- Environ 6% des femmes présentent une augmentation transitoire de l’épaisseur endométriale moyenne > 16 mm. 16,3% des patientes présentent des PAEC après 2 cycles d’ulipristal acétate (7,8% après 1 cycle). Les biopsies relèvent 1 hyperplasie simple et 1 adénocarcinome endométrial déjà diagnostiqué lors de l’examen initial.
Indications et contre-indications d’ulipristal acétate 5 mg
INDICATIONS
- Traitement préopératoire des symptômes modérés à sévères des fi bromes utérins chez la femme adulte en âge de procréer. Un seul cycle de traitement de trois mois. Remboursable et agréé aux collectivités.
- Ce traitement pré-opératoire, outre qu’il permet de corriger l’anémie, a plusieurs intérêts selon les techniques opératoires utilisées en raison de la diminution du volume du ou des myomes (laparotomie, coelio-chirurgie, embolisation, myomectomie hystéroscopique des myomes 0,1 et 2). Du dire des chirurgiens, la dissection du ou des myomes « encapsulés » par le traitement est facilitée : le plan de clivage est optimisé par le traitement.
- Traitement séquentiel des symptômes modérés à sévères des fi bromes utérins chez la femme adulte en âge de procréer. Le traitement séquentiel n’est pas pris en charge à ce jour par la Sécurité Sociale.
Il présente plusieurs intérêts
- Diminution des indications opératoires et correction des anémies (+++)
- Amélioration de la qualité de vie (Figure 5) des patientes 3 : le score de gêne (maximum=28) lié aux myomes – en considérant les saignements, la pression abdominale, la fréquence des mictions, l’activité quotidienne, la fatigue, l’humeur, l’activité sexuelle- passe de 14 à 3 à la semaine 13 versus l’inclusion.
- Diminution significative de la douleur (Figure 5) qui ne concerne plus que 5% des patientes « douleurs modérées à sévères » à la semaine 13 versus 65,5% à l’inclusion 3.
- Il est possible qu’un certain nombre de myomes responsables d’infertilité puisse aussi représenter une indication d’avenir. 7
CONTRE-INDICATIONS
Hypersensibilité à la substance active ou à l’un des excipients, Grossesse et allaitement, Hémorragie génitale d’étiologie inconnue ou pour des raisons autres que des fibromes utérins, Cancers utérin, cervical, ovarien ou du sein.
MISES EN GARDE SPÉCIALES ET PRÉCAUTIONS D’EMPLOI 2
Une grossesse doit être exclue avant traitement. En cas de doute, un test de grossesse devra être réalisé avant de commencer un nouveau cycle de traitement.
Contraception
L’utilisation concomitante d’un contraceptif oral contenant uniquement un progestatif, d’un dispositif intra-utérin libérant un progestatif ou d’un contraceptif oral combiné n’est pas recommandée. Bien que la plupart des femmes prenant une dose thérapeutique d’ulipristal acétate présentent une anovulation, une méthode non hormonale de contraception est recommandée pendant le traitement.
Changements endométriaux
Les changements histologiques désignés comme « Changements endométriaux associés au modulateur du récepteur de la progestérone » (Progesterone Receptor Modulator Associated Endometrial Changes – PAEC) ne doivent pas être confondus avec une hyperplasie endométriale.
De plus, une augmentation réversible de l’épaisseur de l’endomètre peut se produire pendant le traitement. En cas de traitements séquentiels répétés, une surveillance régulière de l’endomètre est recommandée. Ceci inclut une échographie annuelle qui doit être réalisée pendant une période sans traitement, après le retour des règles. Si un épaississement de l’endomètre est observé, qui persisterait après le retour des règles pendant les périodes sans traitement ou au-delà des 3 mois suivant la fin des cycles de traitement, et/ou si une modification du profil de saignements est observée, des examens comprenant une biopsie de l’endomètre doivent être réalisés afin d’exclure d’autres pathologies sous-jacentes, telles que des pathologies malignes de l’endomètre. En cas de diagnostic d’hyperplasie (sans atypie), une surveillance conforme aux pratiques cliniques habituelles (par ex. un contrôle de suivi 3 mois plus tard) est recommandée. En cas de diagnostic d’hyperplasie atypique, des investigations et une prise en charge conformes aux pratiques cliniques habituelles doivent être réalisées 2.
Chaque cycle de traitement ne doit pas excéder 3 mois puisque le risque sur l’endomètre est inconnu pour un traitement prolongé sans interruption.
Profil des saignements
Les patientes doivent être informées que le traitement par ulipristal acétate entraîne généralement une diminution significative des saignements menstruels ou une aménorrhée dans les 10 premiers jours du traitement. Si les saignements excessifs persistent, les patientes doivent en informer leur médecin. Les règles réapparaissent généralement dans les 4 semaines qui suivent la fin de chaque cycle de traitement. Pendant un traitement séquentiel répété, après la réduction initiale des saignements ou l’aménorrhée, si une modification du profil de saignements persistant ou inattendu est observée, telle que la survenue de saignements inter menstruels, un examen de l’endomètre comprenant une biopsie de l’endomètre doit être réalisé afin d’exclure d’autres pathologies sous-jacentes, telles que des pathologies malignes de l’endomètre. Le traitement séquentiel répété a été étudié jusqu’à 4 cycles de traitement séquentiel successifs.
Insuffisance rénale
En cas d’insuffisance rénale, une modification significative de l’élimination de l’ulipristal acétate n’est pas attendue. En l’absence d’études spécifiques, l’ulipristal acétate n’est pas recommandé chez les patientes souffrant d’insuffisance rénale sévère, sauf si la patiente est étroitement surveillée.
Insuffisance hépatique
Il n’existe pas d’expérience clinique avec l’ulipristal acétate chez les patientes atteintes d’insuffisance hépatique. En cas d’insuffisance hépatique, une modification de l’élimination de l’ulipristal acétate est attendue, ce qui entraînerait une augmentation de l’exposition. Cette augmentation de l’exposition n’est pas considérée comme cliniquement pertinente chez les patientes atteintes d’une insuffisance hépatique légère. L’ulipristal acétate n’est pas recommandé chez les patientes atteintes d’insuffisance hépatique modérée ou sévère, sauf si la patiente est étroitement surveillée.
Traitements concomitants
L’utilisation concomitante d’inhibiteurs modérés (par ex. érythromycine, jus de pamplemousse, vérapamil) oupuissants (par ex. kétoconazole, ritonavir, néfazodone, itraconazole, télithromycine, clarithromycine) du CYP3A4 et de l’ulipristal acétate n’est pas recommandée. L’utilisation concomitante de l’ulipristal acétate et d’inducteurs puissants du CYP3A4 (par ex. rifampicine, rifabutine, carbamazépine, oxcarbazépine, phénytoïne, fosphénytoïne, phénobarbital, primidone, millepertuis, efavirenz, névirapine, usage à long terme du ritonavir) n’est pas recommandée.
Asthmatiques
L’utilisation chez des femmes atteintes d’asthme sévère insuffisamment contrôlé par un glucocorticoïde oral n’est pas recommandée.
SCHÉMAS THÉRAPEUTIQUES 2
Le traitement consiste à prendre un comprimé de 5 mg, une fois par jour, pour des cycles de traitement d’une durée maximale de 3 mois chacun.
Le comprimé peut être prit pendant ou en dehors des repas. Les traitements doivent commencer uniquement quand les menstruations apparaissent :
- Le premier cycle de traitement doit débuter au cours de la première semaine de menstruation.
- Les cycles de traitement suivants doivent débuter au plus tôt au cours de la première semaine de la deuxième menstruation après la fin du cycle de traitement précédent.
Le médecin doit informer la patiente que des intervalles sans traitement sont nécessaires. Le traitement séquentiel répété a été étudié jusqu’à 4 cycles de traitement séquentiel successifs. En cas d’oubli d’un comprimé, la patiente doit prendre le comprimé oublié dès que possible. Si l’oubli date de plus de 12 heures, la patiente ne doit pas prendre le comprimé oublié et continuera simplement le schéma de prise habituel.
Conclusion
D’après les données 2 du PMSI-MCO, en 2010, le nombre de séjours hospitaliers pour fibrome utérin est estimé à 46 436 séjours, incluant :
- 20 105 séjours pour hystérectomie ;
- 21 823 séjours pour myomectomies et résections hystéroscopiques.
Sur un total de 10 110 hystérectomies, par laparotomies, voie vaginale ou coelioscopique, Makinen 8 retrouve respectivement pour chaque technique les complications suivantes :
- Infections : incidences de 10,5, 13,0 et 9,0%
- Hémorragies sévères : incidences de 2,1, 3,1 et 2,7%
- Lésions urétérales : risque relatif RR = 7,2 pour la voie coelioscopique versus la laparotomie.
- Lésions intestinales : risque relatif RR = 2,5 pour la voie vaginale versus la laparotomie.
Ulipristal acétate est une innovation importante :
- En pré-opératoire en facilitant le geste chirurgical,
- Ou en séquences répétées pour éviter la chirurgie et sa morbidité et pour améliorer grandement la qualité de vie des patientes.
Enfin, quand on sait que la moitié des hystérectomies sont induites par les myomes en France, on doit s’attendre à un effondrement de cette pratique dans cette indication.
Et ce, pour la grande satisfaction des femmes qui, bien même si elles ne souhaitent plus procréer (pour leur majorité tout du moins) la quarantaine passée souhaitent vivement « garder leur utérus ».
L’auteur déclare ne pas avoir de liens d’intérêts pour cet article.
1. Xu Q. Progesterone receptor modulator C D B – 2 9 1 4 d o w n – regulates vascular endothelial growth factor, adrenomedullin and their receptors and modulates progesterone receptor content in cultured human uterine leiomyoma cells. Human Re p ro d . 2 0 0 6 ; . 2 1 (9):2408–16)
2. RCP Esmya®
3. Donnez J . et al . Ulipristal acetate versus placebo for fibroid treatment before surgery. N Engl J Med 2012 ; 366(5) ; 409-420
4. Donnez J. et al. Ulipristal acetate versus leuprolide acetate for uterine fibroids. N Engl J Med 2012 ; 366(5);421-432.
5. Donnez J. Et al. Efficacy and safety of repeated use of ulipristal acetate in uterine fibroids. Fertil and Steril.2015 F e b ; 103(2) :519-5 2 7 . e 3 . h t t p://dx.doi.org/10.1016/j.fertnstert.2014.10.0386. Donnez. Ulipristal acetate in uterine fibroids. Fertil Steril 2016.
7 . J avier Monleón, Successful Pregnancy after Treatment with Ulipristal Acetate for Uterine Fibroids,Case Rep Obstet Gynecol. 2014; 2014: 314587. Publishedonline 2014 Jul 21. doi: 10.1155/2014/314587
8. Mäkinen J, Morbidity of 10 110 hysterectomies by type of approach. Hum Reprod. 2001 Jul; 16(7):1473-8.







32 commentaires