Responsable d’urétrite chez l’homme et de cervicite chez la femme, Mycoplasma genitalium s’impose comme un acteur majeur des maladies sexuellement transmissibles. Le diagnostic repose sur le test par PCR sur les prélevements. L’azithromycine est l’antibiotique à prescrire en première intention.
Décrit pour la 1re fois en 1980 par l’équipe de Taylor Robinson1, Mycoplasma genitalium s’impose depuis quelques années comme un acteur majeur des infections sexuellement transmissibles. Malheureusement, la mise en évidence de ce Mycoplasme nécessite des techniques d’amplification des acides nucléiques (TAAN) comme la PCR (la culture dure plus de 6 semaines…) qui équipent peu de laboratoires et demeurent hors nomenclature malgré la fréquence de l’infection.
La bactérie Mycoplasma genitalium
Elle fait partie de la famille des Mycoplasmes dont on connaît déjà quelques espèces susceptibles de coloniser le tractus génital : Ureaplasma urea-lyticum et Mycoplasma hominis. Mais contrairement à ces deux dernières bactéries qui sont commensales de la cavité vaginale de la majorité des femmes et dont la transmission sexuelle n’est pas la règle, Mycoplasma genitalium (Mg) fait partie des bactéries responsables d’IST au même titre que Chlamydia trachomatis ou Neisseria gonorrhoeae. Son implication au cours des IST a été décrite pour la première fois chez des hommes atteints d’urétrites non gonococ-ciques et non chlamydiennes (1). Depuis, plusieurs tableaux cliniques tant masculins que féminins ont été décrits pour lesquels la responsabilité de Mg est avérée.
Epidémiologie et transmission
Mg est détecté entre 1 et 3.3 % dans la population générale (hommes et femmes) avec de grandes variations selon les localisations géographiques (2). A titre de comparaison, l’OMS (3) estime la prévalence mondiale de Chlamydia trachomatis à 2.7 % pour les hommes et 4.2 % pour les femmes et la prévalence de Neisseria gonorrheae à 0.6 % pour les hommes et 0.8 % pour les femmes. La transmission de Mg est sexuelle, essentiellement par rapport génito-génital. Mg a également été isolé à partir de prélèvements anaux et la transmission par apport ano-génital est donc possible. En revanche, il y a peu d’informations sur le risque de transmission lors de fellations, de même que sur le risque de transmission verticale mère-enfant même si Mg a été identifié dans le tractus respiratoire de nouveaux-nés. Cependant, le pouvoir pathogène de Mg étant avéré, sa découverte en cours de grossesse nécessite une prise en charge thérapeutique.Enfin, le taux de transmission sexuelle apparaît comme légèrement inférieur au taux de transmission de Chlamydia trachomatis (4).
Manifestations cliniques
Chez l’homme
C’est à partir de l’urètre de 2 hommes atteints d’uré-trite non gonococcique que MG a été mis en évidence pour la première fois en 1980 (1). Depuis cette date, on sait que Mg est une cause majeure d’urétrite masculine puisqu’on l’identifie dans 10 à 35 % des cas d’urétrites non gonococciques. Selon certaines études, Mg serait aussi fréquent que Chlamydia trachomatis lors des uré-trites non-gonococciques masculines. Mg est également responsable de balanites. En revanche, sa responsabilité dans les épididymites ou les infections du sperme reste discutée.Dans une série non publiée, nous avons pu identifier, à l’Institut Fournier, Mg après massage prostatique chez quelques sujets atteints de prostatites subaiguës.Enfin, moins de 30 % des sujets masculins porteurs de Mg sont asymptomatiques.
Chez la femme
Mg est responsable de cervicites muco-purulentes avec une incidence à peu près similaire à celle de Chlamydia trachomatis. Environ, 40 à 60 % des femmes infectées par Mg sont asymptomatiques et c’est l’urétrite masculine qui fera le diagnostic. Les symptômes les plus fréquents sont des leucorrhées inhabituelles, des métrorragies et, dans moins de 30 % des cas, une association avec des brûlures urétrales et une dysurie.
Dans une étude clinique réalisée il y a une dizaine d’années (5), 59 % des partenaires masculins de patientes porteuses d’une cervicite à Mg, hébergeaient Mg dans l’urètre, ce qui confirme la nécessité de dépister et traiter le partenaire sexuel.
Mg serait également responsable d’endométrites, d’infections génitales hautes (6) et peut-être (études contradictoires) de grossesses ectopiques. Il est important de noter que les traitements habituellement recommandés en cas d’infection génitale haute (ofloxacine, métronidazole +/- ceftriaxone) n’ont pas d’action efficace sur Mg de même que la doxycycline.
Enfin, chez la femme enceinte, plusieurs études retrouvent une corrélation entre Mg et prématurité.
Diagnostic
Comme nous l’avons dit plus haut, Mg est une bactérie dont la mise en évidence par culture prend plusieurs semaines ce qui rend cette méthode de diagnostic totalement inappropriée.
Des techniques de TAAN, et en particulier par PCR, permettent maintenant un diagnostic rapide à partir d’un prélèvement cervico-vaginal et/ou anal chez la femme et, chez l’homme, d’un 1er jet d’urines (et/ou prélèvement anal chez l’homme homosexuel). Ces tests sont très sensibles et permettent de dépister l’infection quelques jours après le contage.
On considère qu’un test négatif 3 semaines après un rapport possiblement contaminant élimine le risque d’infection par Mg.
Le test par PCR n’est malheureusement pas disponible dans tous les laboratoires et demeure hors nomenclature malgré l’incidence importante de cette infection. Cela représente un frein au dépistage de cette infection car le coût de l’examen varie beaucoup d’un laboratoire* à l’autre et n’est pas toujours à la portée de nos patientes. Il n’y a aucun test sérologique disponible actuellement.
En cas d’impossibilité de faire pratiquer un test diagnostique, on pourra recourir à un traitement probabiliste.
Traitement
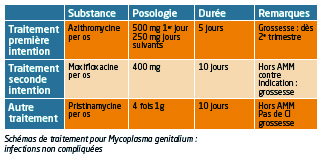
Les antibiotiques classiquement prescrits au cours des infections à Ureaplasma urealyticum ou Mycoplasma hominis, tels que la doxycycline sont inefficaces sur Mg (plus de 70 % d’échecs) de même que l’azithromycine à dose unique prescrite lors des infections à Chlamydia trachomatis.
En revanche, l’azithromycine en cure plus prolongée (2 comprimés soit 500 mg le 1er jour suivis de 1 comprimé à 250 mg par jour pendant 4 jours) a montré une bonne efficacité. Quelques résistances commencent à apparaître mais ne disqualifient pas cet antibiotique dans l’immédiat. En seconde intention, un antibiotique de la famille des fluoroquinolones, la moxifloxacine, à raison de 400 mg par jour pendant 7 à 10 jours, donne de bons résultats. Ce traitement est hors AMM dans cette indication.
En dernier recours, la pristinamycine, à raison de 8 comprimés de 500 mg par jour pendant 10 jours, peut être prescrite (hors AMM).
Ces protocoles s’appliquent aussi bien chez l’homme que chez la femme en cas de tableau clinique non compliqué. Les partenaires sexuels doivent être prévenus et examinés.
Etant donné que Mg est une bactérie uniquement transmise lors de contacts sexuels, un bilan sérologique complet doit être proposé (VIH, syphilis, hépatites).
En cas d’infection compliquée (épididymite, salpingite), on prescrira une cure de moxifloxacine, 400 mg per os par jour pendant 14 jours.
En cas de disparition des symptômes après traitement, il est inutile de contrôler la guérison par un examen biologique. Dans les autres cas, les tests de contrôle par PCR ne doivent pas être prescrits à moins de 3 semaines de la fin de l’antibiothérapie.
Au total
Mycoplasma genitalium est un acteur majeur de la pathologie sexuellement transmissible avec probablement une incidence égale ou à peine inférieure à celle de Chlamydia trachomatis. Les tableaux cliniques sont très voisins de ceux observés avec Chlamydia trachomatis. Malheureusement, la prise en charge optimale de ces infections se heurte au faible nombre de laboratoires équipés pour le diagnostic et au non remboursement des tests PCR. En cas d’impossibilité d’asseoir son diagnostic par la biologie ou en cas d’échec des traitements classiques des cervicites (azithromycine dose unique ou doxycycline), une antibiothérapie probabiliste (cure prolongée d’azithromycine) peut être prescrite.
*A titre indicatif, le laboratoire de l’Institut Fournier facture ce test à moins de 28 €.
Jean-Marc BOHBOT, Institut Fournier, Paris
L’auteur déclare n’avoir aucun lien d’intérêt pour cet article.
RÉFÉRENCES
1. Tully J. G., Taylor-Robinson D., Cole R. M., Rose D. A newly discovered mycoplasma in the human urogenital tract. The Lancet. 1981;317(8233):1288–1291. doi: 10.1016/s0140-
6736(81)92461-2.
2. Jensen JS, Cusini M, Gomberg M 2016 European guideline on Mycoplasma genitalium infections
3. Newman L, Rowley J, Vander Hoorn S, Wijesooriya NS, Unemo M, Low N, et al. Global estimates of the prevalence and incidence of four curable sexually transmitted infections in 2012
based on systematic review and global reporting. PLoS One. 2015;10(12):e0143304
4. Walker J, Fairley CK, Bradshaw CS, et al. The difference in determinants of Chlamydia Trachomatis and Mycoplasma genitalium in a sample of young Australian women. BMC Infect Dis
2011; 11:35
5. Falk L., Fredlund H., Jensen J. S. Signs and symptoms of urethritis and cervicitis among women with or without Mycoplasma genitalium or Chlamydia trachomatis infection. Sexually
Transmitted Infections. 2005;81(1):73–78.
6. Simms I., Eastick K., Mallinson H., et al. Associations between Mycoplasma genitalium, Chlamydia trachomatis and pelvic inflammatory disease. Journal of Clinical Pathology.
2003;56(8):616–618. doi: 10.1136/jcp.56.8.616






38 commentaires